Биохимия
Строение ферментов
Давно выяснено, что все ферменты являются белками и обладают всеми свойствами белков. Подобно белкам они делятся на простые и сложные.
Простые ферменты состоят только из аминокислот – например, пепсин, трипсин, лизоцим.
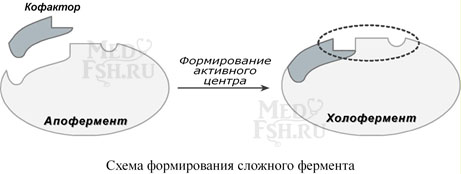
Сложные ферменты (холоферменты) имеют в своем составе белковую часть, состоящую из аминокислот – апофермент, и небелковую часть – кофактор. Кофактор, в свою очередь, может называться коферментом или простетической группой. Примером могут быть сукцинатдегидрогеназа (содержит ФАД), аминотрансферазы (содержат пиридоксальфосфат), пероксидаза (содержит гем).

У сложных ферментов в активном центре обязательно расположены функциональные группы кофактора. Кофактор участвует в связывании субстрата или в его превращении. Для осуществления катализа необходим полноценный комплекс апобелка и кофактора, по отдельности катализ они осуществить не могут.
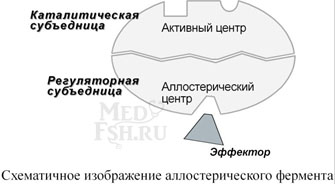
Аллостерический центр (allos – чужой) – центр регуляции активности фермента, который пространственно отделен от активного центра и имеется не у всех ферментов. Связывание с аллостерическим центром какой-либо молекулы (называемой активатором или ингибитором, а также эффектором, модулятором, регулятором) вызывает изменение конфигурации белка-фермента и, как следствие, скорости ферментативной реакции. В качестве такого регулятора может выступать продукт данной или одной из последующих реакций, субстрат реакции или иное вещество (см «Регуляция активности ферментов»).
Аллостерические ферменты являются полимерными белками, их активный и регуляторный центры находятся в разных субъединицах.
Изоферменты
Изоферменты – это молекулярные формы одного и того же фермента, возникшие в результате небольших генетических различий в первичной структуре фермента, но катализирующие одну и ту же реакцию.
Изоферменты отличаются сродством к субстрату, максимальной скорости катализируемой реакции, разной чувствительности к регуляторам (ингибиторы и активаторы), условиям работы (оптимум pH и температуры).
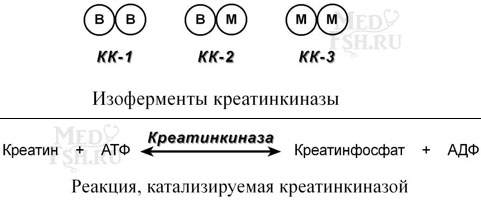
Как правило, изоферменты имеют четвертичную структуру, т.е. состоят из двух или более субъединиц. Например, димерный фермент креатинкиназа представлен тремя изо- ферментными формами, составленными из двух типов субъединиц: M (англ. muscle – мышца) и B (англ. brain – мозг). Креатинкиназа-1 состоит из субъединиц типа B, локализуется в головном мозге, креатинкиназа-2 – по одной М и В субъединице активна в миокарде, креатинкиназа-3 – две М-субъединицы, специфична для скелетной мышцы.
Еще одним примером изоферментов является группа гексокиназ, которые присоединяют фосфатную группу к глюкозе и вовлекают глюкозу в реакции клеточного метаболизма. Из четырех изоферментов выделяется гексокиназа IV (глюкокиназа) которая отличается от остальных изоферментов низким сродством к глюкозе и нечувствительностью к ингибированию продуктом реакции.
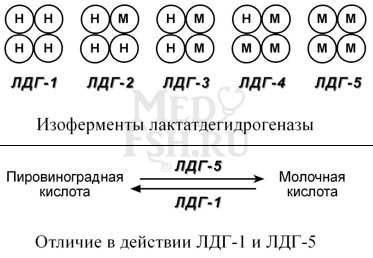
Также существует пять изоферментов лактатдегидрогеназы (ЛДГ) – фермента, участвующего в обмене глюкозы. Отличия между ними заключаются в разном соотношении субъединиц Н (англ. heart – сердце) и М (англ. muscle – мышца). Лактатдегидрогеназы типов 1 (Н4) и 2 (H3M1) присутствуют в тканях с аэробным обменом (миокард, мозг, корковый слой почек), обладают высоким сродством к молочной кислоте (лактату) и превращают его в пируват. ЛДГ-4 (H1M3) и ЛДГ-5 (М4) находятся в тканях, склонных к анаэробному обмену (печень, скелетные мышцы, кожа, мозговой слой почек), обладают низким сродством к лактату и катализируют превращение пирувата в лактат. В тканях с промежуточным типом обмена (селезенка, поджелудочная железа, надпочечники, лимфатические узлы) преобладает ЛДГ-3 (H2M2).
Мультиферментные комплексы
В мультиферментном комплексе несколько ферментов (например, Е1, Е2, Е3) прочно связаны между собой в единый комплекс и осуществляют ряд последовательных реакций, в которых продукт реакции непосредственно передается на следующий фермент и является только его субстратом. Благодаря таким комплексам значительно ускоряется скорость превращения молекул.
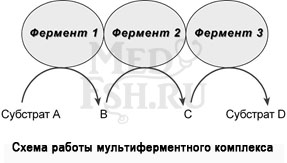
К ним относятся, например, пируватдегидрогеназный комплекс, превращающий пируват в ацетил-SКоА, α-кетоглутаратдегидрогеназный комплекс, превращающий α-кетоглутарат в сукцинил-SКоА, комплекс под названием «синтаза жирных кислот» (или пальмитатсинтаза), синтезирующий пальмитиновую кислоту.