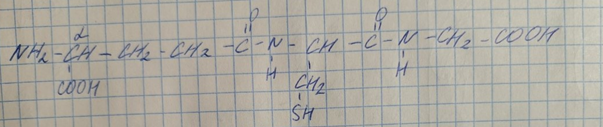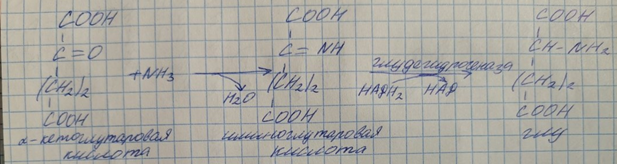Специфические пути обмена аминокислот. Обезвреживание аммиака
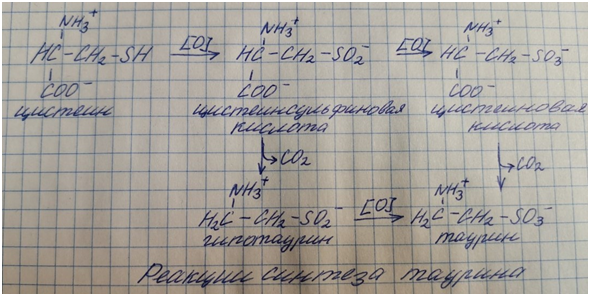
Особенности обмена цистеина
Формула: HOOC – CH(-NH2)-CH2-SH.
Цистеин является чрезвычайно важной аминокислотой в связи с тем, что это единственный источник органической серы для клеток организма. В результате реакций метаболизма эта сера переходит в состав других серосодержащих веществ – фасфоаденозинфосфосерная кислота(ФАФС), коэнзим А, глутатион, сульфированные производные углеводов (хондроитинсульфат, кератансульфат, дерматансульфат) или выводится почками в виде сульфатов.
Одним из производных является таурин, обладающий следующими функциями: является обязательным компонентом желчных кислот и играет роль внутриклеточного антиоксиданта.

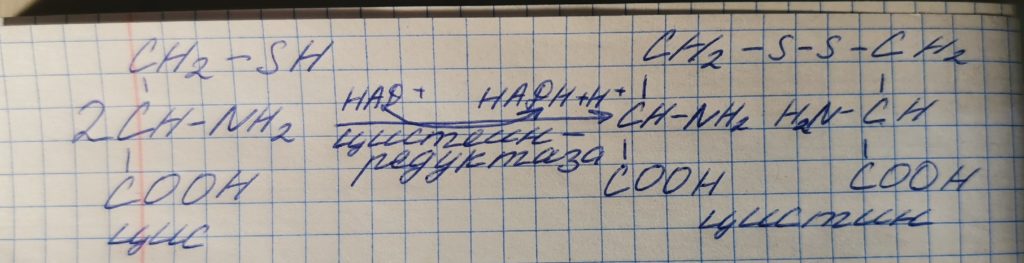

Структура «активного метионина», участие кофермента S-аденозилметионина в реакциях трансаминирования
Метионин – незаменимая аминокислота, необходимая для синтеза белков. Участвует в инициации синтеза белка (трансляция). Взаимодействие метионина с первым кодоном иРНК является необходимым для создания первой пептидной связи будущего белка.
Как и многие другие аминокислоты подвергается трансаминированию и дезаминированию.
Особая роль метионина заключается в том, что метильная группа этой аминокислоты используется для синтеза целого ряда соединений в реакциях трансметилирования. Основным донором метильной группы является S-аденозилметионин (SAM) – активная форма метионина, который присутствует во всех типах клеток и синтезируется из метионина и АТФ под действием метионинаденозилтрансферазы:

-S(+)-CH3 в SAM является нестабильной, метильная группа легко отщепляется, что определяет высокую способность её к переносу на другие соединения в реакциях трансметилирования. В реакциях трансметилирования SAM превращается в S-аденозилгомоцистеин (SАГ), который гидролитически расщепляется с образованием аденозина и гомоцистеина. Последний может снова превращаться в метионин с участием метил-Н4-фолата и витамина B12. Регенерация метионина тесно связана с обменом серина и глицина и взаимопревращениями производных Н4-фолата:
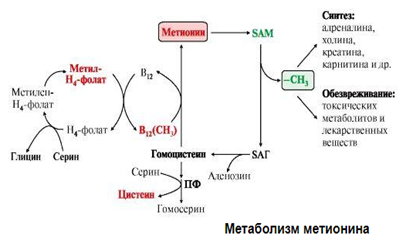
Цистеин образуется непосредственно из гомоцистеина в ходе двух реакций. SAM как донор метильной группы участвует в синтезе многих веществ, например:

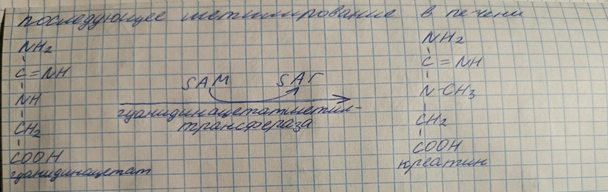
А также в инактивации нормальных метаболитов и обезвреживании токсических веществ в печени.
Гомоцистеин, роль витамина B12 и фолиевой кислоты в обмене гомоцистеина. Гомоцистеинемия и гомоцистеинурия
Гомоцистеин – непротеиногенная аминокислота. Гомолог аминокислоты цистеина, от которого отличается метиленовой группой (-CH2).
Гомоцистеин не поступает с пищей, вместо этого он биосинтезируется из метионина в многостадийном процессе. Сначала из метионина образуется S-аденозилметионин (SAM). Затем при помощи фермента цитинозил-5-метилтрансферазы SAM передаёт свою метильную группу на цитозин в ДНК, образуя S-аденозилгомоцистеин. Фермент аденозилгомоцистеиназа затем катализирует гидролиз этого продукта до образования гомоцистеина. Гомоцистеин может быть обратно конвертирован в метионин при помощи витаминов группы B.
Образованный в реакции распада серина до глицина N5-10-метилен-ТГФК при участии фермента метилен-ТГФК-редуктазы превращается в N5-метил-ТГФК. Она участвует в метионин-синтазной реакции ремитилирования гомоцистеина в метионин. Метионин в последствии присоединяет аденозильный остаток и превращается в активную форму метионина – S-аденозилметионин, участвующий во многих реакциях метилирования, в частности, синтеза креатина, адреналина, фосфатидилхолина. В результате перемещения метильной группы и отщепления аденозина остается гомоцистеин, имеющий 2 пути метаболизма. Первый путь – реметилирование до метионина и вновь участие в реакциях метилирования. Второй путь – взаимодействие с серином при участии цистатионсинтазы, превращение в цистатион с последующим распадом в цистеин и гомосерин.
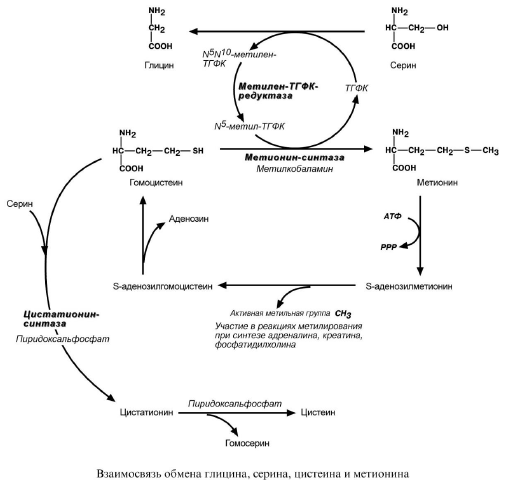
Витамин B12 и фолиевая кислота необходимы для протекания реакций превращения гомоцистеина.
Гомоцистеинемия
—Накопление гомоцистеина в крови.
Причины:
1) Наследственный дефект ферментов – метионинсинтазы, цистатионсинтазы, метилен-ТГФК-редуктазы:
*гомозиготный дефект цистатионсинтазы, частота 1:100000, наблюдается повышение уровня общего гомоцистеина натощак до 40 раз.
- гораздо чаще причиной умеренной гипергомоцистеинемии является гомозиготный дефицит метилен-ТГФК-редуктазы (пиридоксинрезистентная форма), при которой фермент имеет половинную активность от нормы,
- нарушенная активность метионинсинтазы, одновременно наблюдается повышение концентрации метилмалоновой кислоты.
2) Недостаток витаминов B12, B6, B9, которые участвуют в метаболизме гомоцистеина.
Патогенез: гомоцистеин, растворенный в плазме провоцирует свободнорадикальное окисление липидов в липопротеинах крови и тем самым их задержку в крови, ускоряет агрегацию тромбоцитов, вызывает повреждения эндотелия сосудов.
Лечение: названные витамины, диета – со сниженным содержанием метионина.
Гомоцистеинурия
—Наследственное нарушение обмена метионина.
1)Классическая гомоцистеинурия – дефицит фермента цистатион-бета-синтазы.
2)Гомоцистеинурия, обусловленная дефицитом фермента метилен-ТГФК-редуктазы
3)Гомоцистеинурия, обусловленная нарушением метаболизма кобаламина. Патогенез: происходит накопление продуктов гомоцистеина и его метаболитов в крови и моче. Нарушает функции белков, повреждение ЦНС.
Структура глутатиона и его биологическая роль
Формула глутатиона:
Синтез:
Функции:
- является коферментом пероксидазы;
- участвует в работе глутатионтрасферазы – фермента, поэтапно окисляющего супероксидный радикал кислорода
- участвует в восстановлении окисленных белков, липидов, нуклеиновых кислот
- участвует в окислении токсических продуктов перекисного окисления (ацетальдегида и др.)
- резерв цистеина для клетки
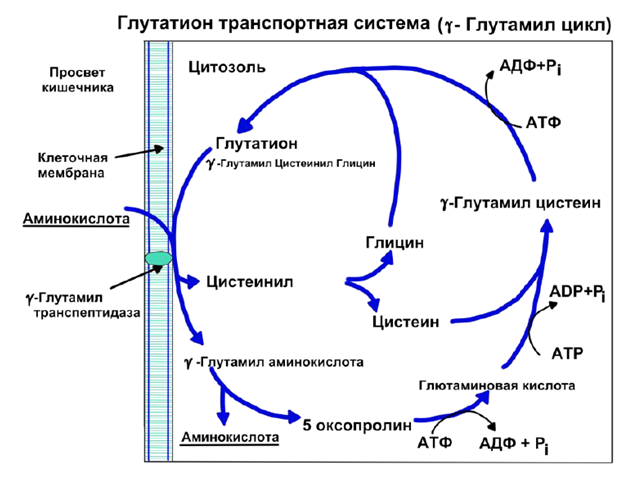
- принимает участие в переносе аминокислот через клеточную мембрану с помощью y-глутамилтраспептидазы.
Перенос аминокислот глутатионом:
При связывании глутатиона с аминокислотой образуется комплекс, при помощи фермента глутамилтрансферазы происходит связывание (фермент расположен на слизистой кишки). Далее этот комплекс входит в клетку. Внутри от глутатиона отщепляется цистеин и глицин, а затем и остаток глутатиона (y-глутамил) отщепляется от аминокислоты. Таким образом, аминокислота перенесена внутрь, а развалившийся глутатион собирается обратно ферментами и снова готов к работе.
Особенности обмена глицина
При превращении серина в глицин образуется N5,N10-метилен-ТГФК:
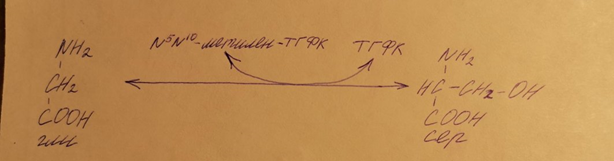
Из глицина могут образовываться:
- порфирины – гемоглобин
- серин ——> фосфолипиды
- парные желчные кислоты
- пуриновые основания и нуклеиновые кислоты
- креатин и креатинфосфат
- гиппуровая кислота
- глутатион
- глиоксиловая кислота HOOC-C(=O)-H —> -С(=О)-Н + CO2 – формиат связывается с ТГФК и используется для синтеза ДНК, РНК и т.д.
Обмен фенилаланина и тирозина, наследственные заболевания, связанные с нарушением обмена данных аминокислот
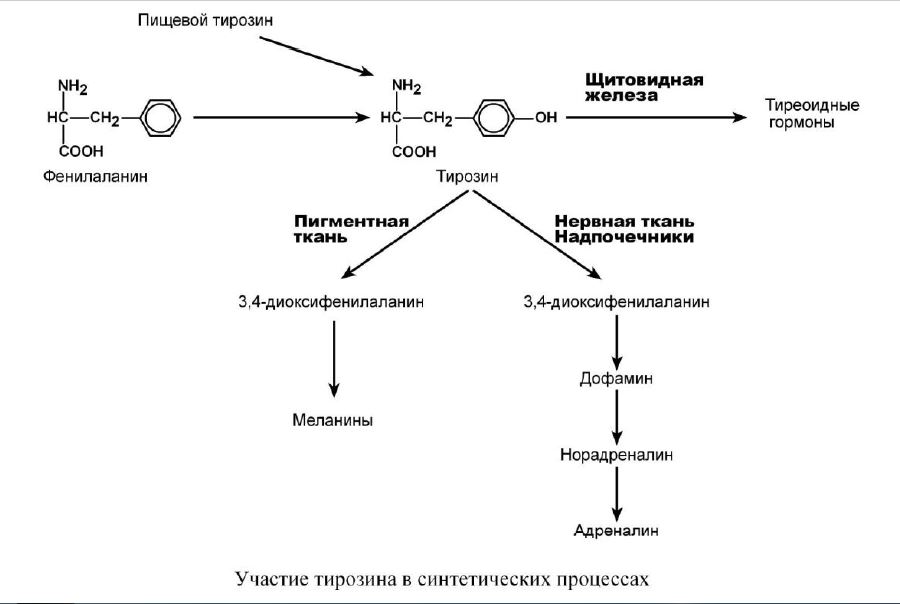
Обмен фенилаланина и тирозина
В организме фенилаланин используется только в синтезе белков. Весь неиспользованный запас аминокислоты превращается в тирозин. Тирозин, кроме синтеза белков, необходим для синтеза тиреоидных гормонов, катехоламинов и пигментов.
Катаболизм фенилаланина и его нарушения
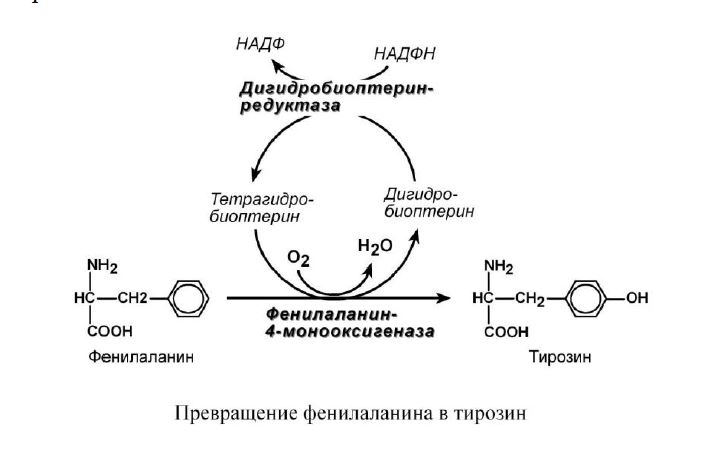
Фенилаланин относится к незаменимым аминокислотам, поскольку ткани животных не обладают способностью синтезировать его бензольное кольцо. В то же время тирозин полностью заменим при достаточном поступлении фенилаланина с пищей. Объясняется это тем, что основной путь превращения фенилаланина начинается с реакции гидроксилирования с образованием тирозина.
Фенилкетонурия I
Этиология. Заболевание вызывает снижение активности фермента фенилаланин-4-монооксигеназы, обеспечивающей превращение фенилаланина в тирозин. Фермент имеется только в печени, почках, поджелудочной железе.
Патогенез. В патогенезе ФКУ имеют значение многие обстоятельства, в частности:
значительное накопление в тканях и жидкостях больного фенилаланина и его производных (фенилпировиноградная, фенилмолочная (миндальная), и вызванный ими ацидоз, прямое токсическое действие указанных веществ на центральную нервную систему, которое заключается в торможении фенилаланином активности ряда ферментов и нарушение синтеза моноаминовых нейромедиаторов — тирамина, октопамина, нарушение синтеза серотонина, т. к. фенилаланин-4-монооксигеназа одновременно осуществляет гидроксилирование триптофана до 5-гидрокситриптофана, предшественника серотонина, o нарушение синтеза простых и сложных белков в тканях, что вызывает тяжелые повреждения мозга и нарушение функции печени у большинства больных.
Клиническая картина. Ребенок с фенилкетонурией выглядит при рождении здоровым. Манифестация ФКУ происходит на первом году жизни, обычно в возрасте 2-6 мес.
Первым симптомом заболевания может стать рвота. Другими ранними проявлениями болезни служат вялость ребенка, чрезмерная сонливость, отсутствие интереса к окружающему, иногда беспокойство, плаксивость, также отмечаются срыгивания, нарушение мышечного тонуса, судороги.
Дети отстают в физическом и нервно-психическом развитии. Характерным признаком является повышенная потливость, от мочи и пота исходит необычный запах фенилуксусной кислоты, который характеризуют как заплесневелый, мышиный или волчий.
Основы лечения. Единственным методом лечения является диетотерапия — исключение продуктов питания с высоким количеством фенилаланина. Вместо натурального белка используют специальные гидролизаты белка, частично или полностью лишенные фенилаланина.
Фенилкетонурия II
Этиология. Дефект дигидробиоптеринредуктазы.
Патогенез. В результате недостаточности фермента нарушается восстановление активной формы тетрагидробиоптерина, участвующего в качестве кофактора гидроксилаз фенилаланина и триптофана. Вследствие этого нарушается превращение фенилаланина в тирозин, триптофана в 5-гидрокситриптофан.
Клиническая картина. В клинической картине преобладает тяжелая умственная отсталость, судороги, признаки повышенной возбудимости, мышечная дистония, хореиформные движения (непроизвольные трясущиеся движения головы, лица или конечностей). Нередко приводит к смерти в 2-3-летнем возрасте.
Основы лечения. В отличие от классической формы этот вариант не поддается лечению ранним ограничением содержания фенилаланина в пище. Лечение тетрагидробиоптерином неэффективно, так как он не проникает через гематэнцефалический барьер. Заместительная терапия L-ДОФА и 5-гидроокситриптофаном частично обходит блок в синтезе дофамина и серотонина.
Обмен тирозина и его нарушения
Тирозин, помимо участия в синтезе белков, является предшественником гормонов надпочечников адреналина, норадреналина, медиатора дофамина, гормонов щитовидной железы тироксина и трийодтиронина, пигментов.
Тирозинемия типа I
Клиническая картина. Существует две формы — острая и хроническая. Острая форма составляет большинство случаев заболевания с началом в возрасте 2-7 мес и смертью 90% больных в возрасте 1-2 года из-за недостаточности печени.
К симптомам относится гипотрофия, рвота, «капустный запах» от тела и мочи, задержка развития, кровоточивость, диарея, мелена, гематурия, желтуха, анемия, слабость мышц, дыхательные нарушения. Отмечают гипогликемию вследствие гиперплазии островковых клеток поджелудочной железы.
При хронической форме болезнь развивается позднее, медленнее прогрессирует. Продолжительность жизни около 10 лет.
Наблюдаются гипотрофия, цирроз печени и печеночная недостаточность, множественные дефекты почечной реабсорбции.
Основы лечения. Используется диета со снижением количества белка, фенилаланина и тирозина, инъекции глутатиона. Лечение малоэффективно. Необходима трансплантация печени.
Тирозинемия типа II
Гораздо более редкое заболевание по сравнению с тирозинемией I типа.
Клиническая картина. Наблюдается задержка умственного и физического развития, микроцефалия, катаракты. Поражения почек и печени не наблюдается.
Основы лечения. Эффективна диета с низким содержанием тирозина, при этом поражения кожи и роговицы быстро исчезают.
Тирозинемия новорожденных
Чаще наблюдается у недоношенных детей.
Клиническая картина. Наблюдается сниженная активность и летаргия. Аномалия считается безвредной. Дефицит аскорбиновой кислоты усиливает клиническую картину.
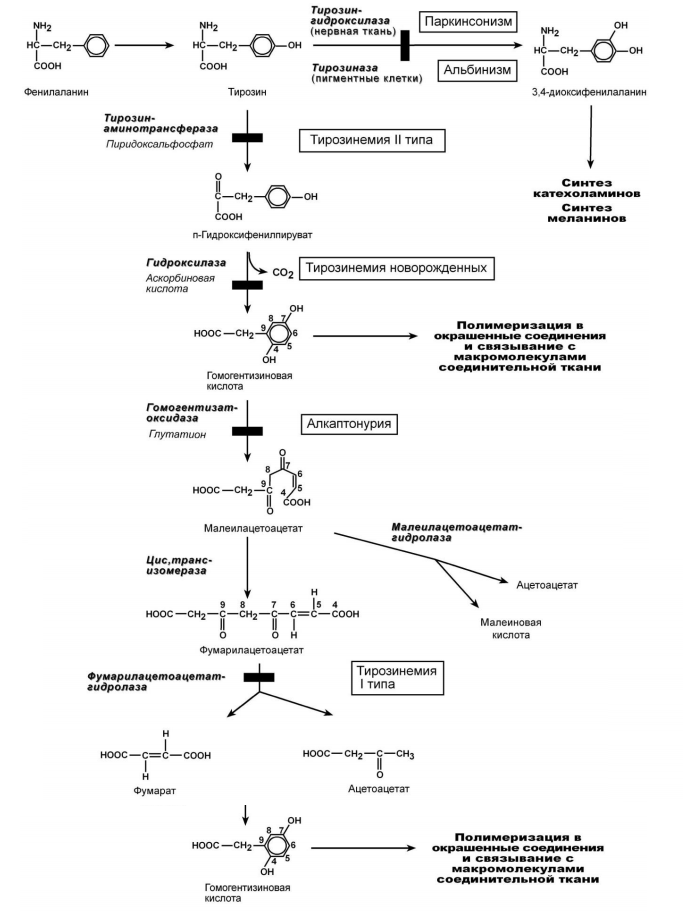
Алкаптонурия
Клиническая картина. Наиболее частым и постоянным симптомом является темная моча. Другим образом в детском возрасте болезнь не проявляется. С возрастом темное окрашивание хрящей, суставов, артрит.
Альбинизм
Клиническая картина. При полном отсутствии фермента — тотальная депигментация кожи, волос, глаз, причем окраска одинакова для всех расовых групп и не меняется с возрастом. Кожа не загорает, совершенно отсутствуют какие-либо пигментные пятна. Сильно выражены нистагм, светобоязнь, дневная слепота (т. к. имеется депигментация сетчатки и ускоренный распад родопсина), красный зрачковый рефлекс.
Основы лечения. Рекомендуется использовать различные средства защиты от ультрафиолетовых лучей.
Паркинсонизм
Клиническая картина. Наиболее распространенными симптомами являются ригидность мышц, скованность движений, тремор и самопроизвольные движения.
Основы лечения. Требуется систематическое введение лекарственных аналогов дофамина и применение ингибиторов моноаминоксидазы.
Источники и механизмы образования свободного аммиака в организме
Наиболее активными продуцентами в кровь являются органы с высоким обменом аминокислот и биогенных аминов – нервная ткань, печень, кишечник, мышцы.
Основные источники:
- неокислительное дезаминирование некоторых аминокислот (серина, треонина, гистидина) – в печени.
- окислительное дезаминирование глютаминовой кислоты во всех тканях, кроме мышечной.
- катаболизм биогенных аминов – во всех тканях, в наибольшей степени – в нервной ткани.
- дезаминирование амидов глютаминовой и аспарагиновой кислот – в печени и почках.
- жизнедеятельность бактерий толстого кишечника.
- распад пуриновых и пиримидиновых оснований во всех тканях.

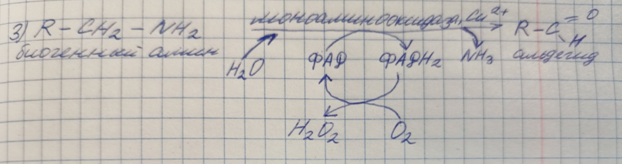

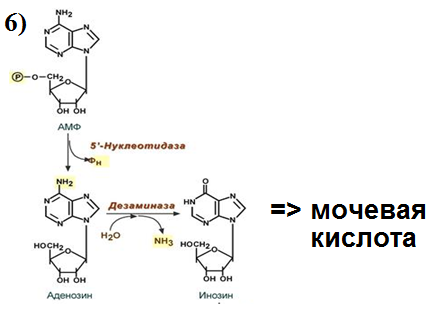
Характеристика основных путей обезвреживания аммиака. Временное обезвреживание аммиака, виды, химизм, ферменты, значение
Аммиак токсичен, особенно для нервной системы.
Норма аммиака 11-32 мкмоль/литр. При его увеличении происходит возбуждение нервной системы. Критический уровень — 60 мкмоль/литр – угнетение ЦНС и кома.
Небольшая часть аммиака может идти на синтез заменимых аминокислот, азотистых оснований и т.д. Большая часть аммиака удаляется.
Временное обезвреживание аммиака – во всех тканях, наиболее активно в нейронах, образуются амиды аспарагиновой и глутаминовой кислоты.
Пути обезвреживания аммиака:
1) образование амидов (аспарагиновой и глутаминовой кислот)
Далее глутамин и аспарагин током крови доставляются в печень и почки, где происходит окончательная детоксикация.
2) синтез аммонийных солей
3) восстановительное аминирование альфа-кетоглутаровой кислоты
4) синтез мочевины – основной путь обезвреживания аммиака (подробнее в 10 пункте).
Значение – аммиак токсичен, поэтому его нужно превратить в «безобидное» соединение либо удалить из организма. Мочевина, синтезируемая из аммиака, намного менее токсична, чем аммиак.
Схема выведения аммиака с мочой, биологическая роль
Аммиак токсичен, поэтому его нужно реутилизировать:
1) При синтезе глутамата происходит отток альфа-кетоглутарата из ЦТК, при этом понижается образование энергии АТФ и ухудшается деятельность клеток.
2) Ионы NH4+ вызывают защелачивание плазмы крови. При этом повышается сродство гемоглобина к кислороду (эффект Бора), гемоглобин не отдает кислород в капиллярах, в результате наступает гипоксия клеток.
3) Накопление свободного иона NH4+ в цитоплазме конкурентно влияет на работу внутренних ферментов и он конкурирует с ионными каналами для Na+ и K+.
4) Глутамин, являясь осмотически активным веществом, приводит к задержке воды в клетках и их набуханию, что вызывает отёк тканей. В случае нервной ткани это может вызвать отёк мозга, кому и смерть.
5) Использование альфа-кетоглутарата и глутамата для нейтрализации аммиака вызывает снижение синтеза ГАМК – тормозного медиатора н.с.
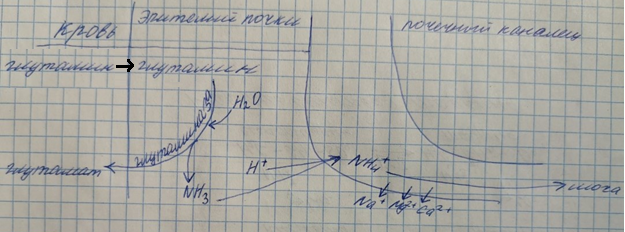
Практически весь аммиак удаляется из организма:
- В виде образующихся в эпителии канальцев почек солей иона аммония:
- С мочой в виде мочевины, которая синтезируется в печени (Орнитиновый цикл мочевинообразования)
Орнитиновый цикл мочевинообразования: химизм, ферменты, энергетическая обеспеченность, связь с циклом трикарбоновых кислот и восстановительным аминированием
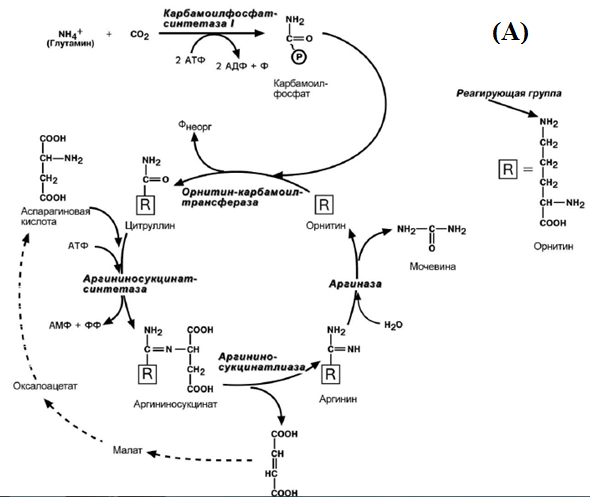
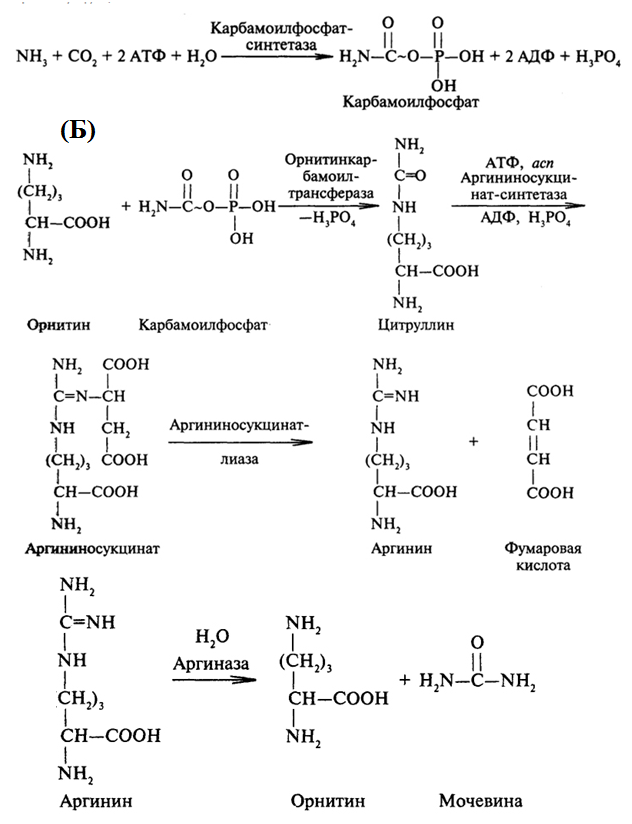
Синтез мочевины начинается в митохондриях (первая и вторая реакции), оставшиеся 3 идут в цитоплазме. Для переноса цитруллина и орнитина через митохондриальную мембрану существуют специальные переносчики. В образовании одной молекулы мочевины участвуют 1 молекула NH4+, 1 молекула CO2, аминогруппа, 1 молекула аспарагиновой кислоты, затрачивается 4 макроэргические связи 3 молекул АТФ.
Взаимосвязь ЦТК и Орнитинового цикла.
Фумарат, образующийся в результате расщепления аргининосукцината, превращается в малат, который затем переносится в митохондрии, включается в ЦТК и дегидрируется с образованием ЩУК. Эта реакция сопровождается выделением 3 молекул АТФ, которые и компенсируют затраты энергии на синтез одной молекулы мочевины.