Биохимия
Уровни организации белковой структуры
Белок – это последовательность аминокислот, связанных друг с другом пептидными связями. Если количество аминокислот не превышает 10, то новое соединение называется пептид; если от 10 до 40 аминокислот – полипептид, если более 40 аминокислот – белок.
Линейная молекула белка, образующаяся при соединении аминокислот в цепь при помощи пептидных связей, является первичной структурой. Образно ее можно сравнить с обычной нитью, на которую навешено до нескольких сотен бусинок двадцати различных цветов (по числу аминокислот). Строение аминокислот, их последовательность и соотношение в первичной структуре определяет дальнейшее поведение молекулы: ее способность изгибаться, сворачиваться, формировать те или иные связи внутри себя.
Формы молекулы, создаваемые при свертывании, последовательно могут принимать вторичный, третичный и четвертичный уровень организации.
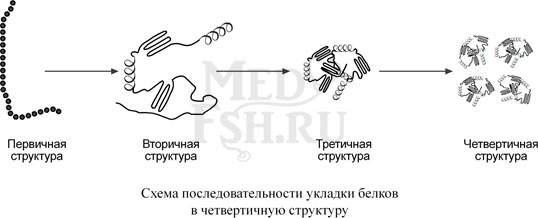
На уровне вторичной структуры белковые «бусы» способны укладываться в виде спирали (подобно дверной пружине) и в виде складчатого слоя, когда «бусы» уложены змейкой и удаленные части «бус» оказываются рядом.
Укладка белка во вторичную структуру плавно переходит в формирование третичной структуры. Третичная структура – это отдельные глобулы, в которых белок уложен компактно, в виде трехмерного клубка.
Некоторые белковые глобулы существуют и выполняют свою функцию не поодиночке, а группами по две, три и более штук. Такие группы образуют четвертичную структуру белка.
Первичная структура
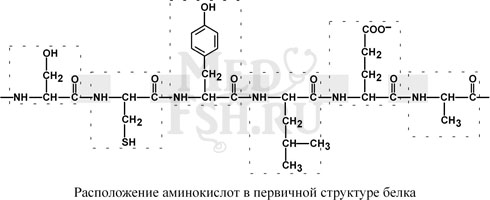
Это последовательность аминокислот в полипептидной цепи. Учитывая, что в синтезе белков принимает участие 20 аминокислот и средний белок содержит 500 аминокислотных остатков, то можно говорить о невообразимом количестве потенциально возможных белков. В организме человека обнаружено около 100 тысяч различных белков.
Первичная структура белков задается последовательностью нуклеотидов в ДНК. Выпадение, вставка, замена нуклеотида приводит к изменению аминокислотного состава и, следовательно, структуры синтезируемого белка.
Например, при серповидноклеточной анемии в 6 положении бета-цепи гемоглобина происходит замена Глу на Вал. Это приводит к синтезу HbS – такого гемоглобина, который в дезоксиформе полимеризуется и образует кристаллы. В результате эритроциты деформируются, приобретают форму серпа (банана), теряют эластичность и при прохождении через капилляры разрушаются. Это в итоге приводит к анемии, снижению оксигенации тканей и их некрозу.
Если изменение последовательности аминокислот носит не летальный характер, а приспособительный или хотя бы нейтральный, то такой белок может передаться по наследству и остаться в популяции. В результате возникают новые белки и новые качества организма. Такое явление называется полиморфизм белков.
К примеру, возникновение групп крови АВ0 связано с тремя вариантами фермента, осуществляющего присоединение к олигосахариду мембран эритроцитов либо N-ацетилгалактозы (группа А), либо галактозы (группа В), либо фермент не присоединяет дополнительные сахаридные группы (группа 0).
Последовательность и соотношение аминокислот в первичной структуре определяет формирование вторичной, третичной и четвертичной структур.
Вторичная структура
Вторичная структура – это способ укладки полипептидной цепи в упорядоченную структуру, при которой аминокислоты взаимодействуют через пептидные группы.
Формирование вторичной структуры вызвано стремлением пептида принять конформацию с наибольшим количеством водородных связей между пептидными группами. Вторичная структура определяется:
- устойчивостью пептидной связи,
- подвижностью С-С связи,
- размером аминокислотного радикала.
Все это вкупе с аминокислотной последовательностью приводит к строго определенной конфигурации белка.
Можно выделить два возможных варианта вторичной структуры: α-спираль (α-структура) и β-структура (β-складчатый слой).
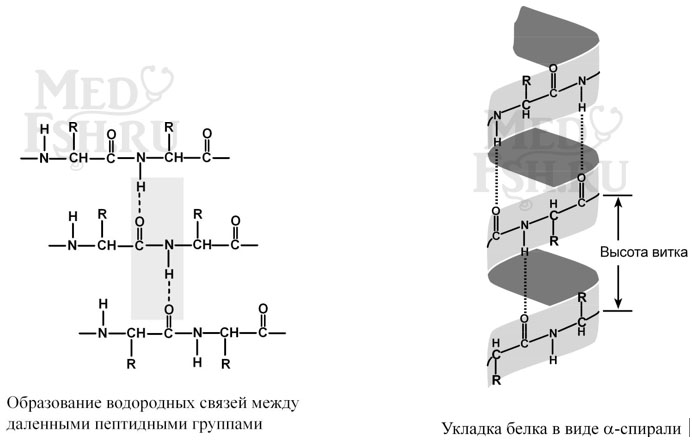
Вторичная структура образуется при участии только водородных связей между пептидными группами: атом кислорода одной группы реагирует с атомом водорода следующей, одновременно кислород этой пептидной группы связывается с водородом еще одной и т.д. В одном белке, как правило, одновременно присутствуют α-спираль и β-структура. В глобулярных белках преобладает α-спираль, в фибриллярных – β-складчатый слой.
α-спираль
Правозакрученная спираль, образуется при помощи водородных связей между пептидными группами 1-го и 4-го, 4-го и 7-го, 7-го и 10-го и так далее аминокислотных остатков.
Формированию спирали препятствуют пролин и гидроксипролин, которые обусловливают “перелом” цепи, ее резкий изгиб.
Высота витка составляет 0,54 нм и соответствует 3,6 аминокислотных остатков, 5 полных витков соответствуют 18 аминокислотам и занимают 2,7 нм.
β-складчатый слой
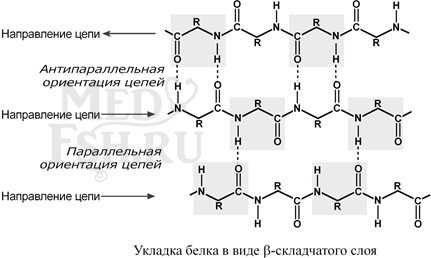
При формировании β-структуры аминокислоты одной белковой цепи взаимодействуют друг с другом при помощи водородных связей между пептидными группами. В этом способе укладки белковая молекула лежит «змейкой», удаленные отрезки цепи оказываются поблизости друг от друга. В результате пептидные группы ранее удаленных аминокислот белковой цепи оказываются рядом и способны взаимодействовать при помощи водородных связей.
Ориентация реагирующих участков может быть параллельна (когда соседние цепи идут в одном направлении) или антипараллельна (цепи идут в противоположном направлении).
Под направлением белковой цепи понимают направление от N-конца (N-концевой аминокислоты) к C-концу (С-концевой аминокислоте).
Таких взаимодействующих друг с другом участков одного белка может быть от двух до пяти.
Третичная структура
Третичная структура – это укладка полипептидной цепи в глобулу («клубок»). Четкой границы между вторичной и третичной структурами провести нельзя, в основе третичной структуры лежат стерические взаимосвязи между аминокислотами, отстоящими далеко друг от друга в цепи. Благодаря третичной структуре происходит еще более компактное формирование цепи.
Наряду с α-спиралью и β-структурой в третичной структуре обнаруживается так называемая неупорядоченная конформация, которая может занимать значительную часть молекулы. В разных белках наблюдается разное соотношение типов структур. Например, инсулин содержит 52% α-спирали и 6% β-структуры, трипсин – 14% α-спирали и 45% β-структуры.
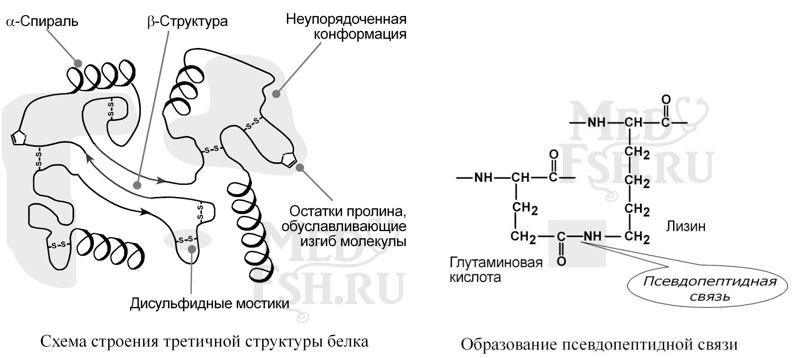
Аминокислоты принимают участие в формировании третичной структуры, образуя связи между своими функциональными группами (радикалами):
- водородные – между ОН-, СООН-, NH2-группами радикалов аминокислот,
- дисульфидные – между остатками цистеина,
- гидрофобные – между остатками алифатических и ароматических аминокислот,
- ионные – между СООН-группами глутамата и аспартата и NH2-группами лизина и аргинина,
- псевдопептидные – между дополнительными СООН-группами глутамата и аспартата и дополнительными NH2-группами лизина и аргинина.
Четвертичная структура
Если белки состоят из двух и более полипептидных цепей, связанных между собой нековалентными (не пептидными и не дисульфидными) связями, то говорят, что они обладают четвертичной структурой. Такие агрегаты стабилизируются водородными связями, ионными и электростатическими взаимодействиями между остатками аминокислот, находящихся на поверхности глобулы.
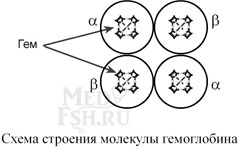
Подобные белки называются олигомерами, а их индивидуальные цепи – протомерами (мономерами, субъединицами). Если белки содержат 2 протомера, то они называются димерами, если 4, то тетрамерами и т.д. Например, гемоглобин – белок эритроцитов, переносящий кислород, состоит из 4 гемсодержащих субъединиц – 2 α-субъединицы и 2 β-субъединицы в гемоглобине взрослых, 2 α-субъединицы и 2 γ-субъединицы в фетальном гемоглобине.
Лактатдегидрогеназа – фермент, принимающий активное участие в окислении глюкозы при мышечном сокращении, также включает 4 субъединицы – Н (heart) и М (muscle) в разных сочетаниях: Н4, Н3М1, Н2М2, Н1М3, М4. Всего 5 изоферментов.
Креатинкиназа – фермент, участвующий в регенерации АТФ при мышечном сокращении, состоит из 2 субъединиц – В (brain) и М (muscle) в разных сочетаниях: ВВ, ВМ, ММ. Всего 3 изофермента.
Взаимодействие протомеров друг с другом осуществляется по принципу комплемен- тарности, т.е. их поверхность подходит друг другу по геометрической форме и по функциональным группам аминокислот (возникновение ионных и водородных связей).
Так как субъединицы в олигомерах очень тесно взаимодействуют между собой, то любое изменение конформации какой-либо одной субъединицы обязательно влечет за собой изменение других субъединиц. Этот эффект называется кооперативное взаимодействие. Например, у гемоглобина такое взаимодействие субъединиц в легких ускоряет в 300 раз присоединение кислорода к гемоглобину. В тканях отдача кислорода также ускоряется в 300 раз.
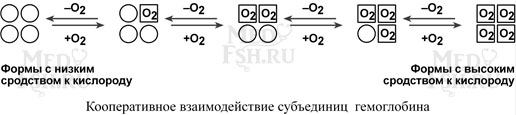
Присоединение в легких первой молекулы кислорода к одной из субъединиц гемоглобина изменяет ее конформацию. В результате она начинает влиять на следующую субъединицу, облегчая присоединение к ней кислорода. После этого они вдвоем влияют на третью субъединицу и так далее. В тканях первая молекула кислорода отделяется от своей субъединицы не очень легко, вторая уже быстрее и т.д.
Дезоксиформа гемоглобина обозначается как Т-форма, напряженная (англ. tense), она обладает существенно более низким сродством к кислороду. Оксигенированная форма, или R-форма (англ. relaxed), обладает высоким сродством к кислороду.