Биохимия
Классификация аминокислот
Из-за разнообразного строения и свойств классификация аминокислот может быть различной, в зависимости от выбранного качества аминокислот. Аминокислоты делятся:
- В зависимости от положения аминогруппы.
- По абсолютной конфигурации молекулы.
- По оптической активности.
- По участию аминокислот в синтезе белков.
- По строению бокового радикала.
- По кислотно-основным свойствам.
- По необходимости для организма.
В зависимости от положения аминогруппы
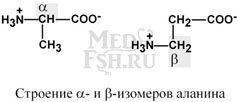
Выделяют альфа, бета, гамма и другие аминокислоты. Для организма млекопитающих наиболее характерны альфа-аминокислот
По абсолютной конфигурации молекулы
По абсолютной конфигурации молекулы выделяют D- и L-формы. Различия между изомерами связаны с взаимным расположением четырех замещающих групп, находящихся в вершинах воображаемого тетраэдра, центром которого является атом углерода в альфа-положении.
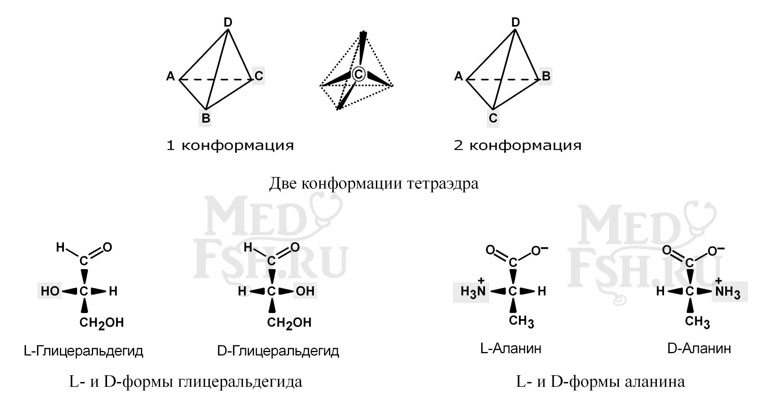
В белке любого организма содержится только один изомер, для млекопитающих это L-аминокислоты. Однако оптические изомеры претерпевают самопроизвольную неферментативную рацемизацию, т.е. L-форма переходит в D-форму.
По оптической активности
По оптической активности аминокислоты делятся на право- и левовращающие.
Наличие ассиметричного атома углерода (хирального центра) делает возможным только два расположения химических групп вокруг него. Это приводит к особому отличию веществ друг от друга, а именно – изменению направления вращения плоскости поляризованного света, проходящего через раствор.
В соответствии с углом поворота выделяют правовращающие (+) и левовращающие (–) изомеры.
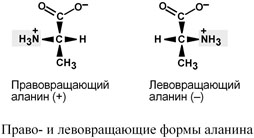
Деление на L- и D-формы не соответствует делению на право- и левовращающие. Для одних аминокислот L-формы (или D-формы) являются правовращающими, для других – левовращающими. Например, L-аланин – правовращающий, а L-фенилаланин – левовращающий. При смешивании L- и D-форм одной аминокислоты образуется рацемическая смесь, не обладающая оптической активность.
По участию аминокислот в синтезе белков
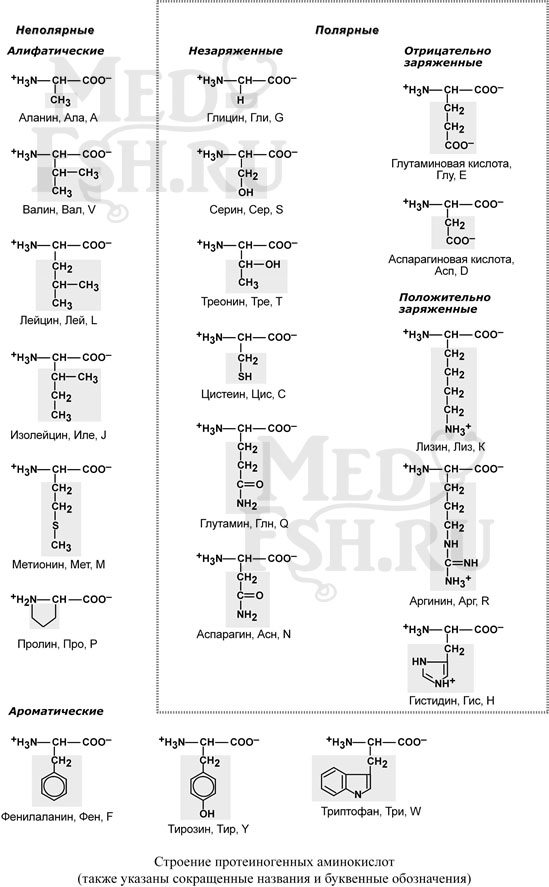
Выделяют протеиногенные (20 АК) и непротеиногенные (около 40 АК). Все протеиногенные аминокислоты являются альфа-аминокислотами.
На примере протеиногенных аминокислот можно показать дополнительные способы классификации:
- по строению бокового радикала – неполярные (алифатические, ароматические) и полярные (незаряженные, отрицательно и положительно заряженные),
- электрохимическая – по кислотно-основным свойствам подразделяют нейтральные (большинство), кислые (Асп, Глу) и основные (Лиз, Арг, Гис) аминокислоты,
- физиологическая классификация – по необходимости для организма выделяют незаменимые (Лей, Иле, Вал, Фен, Три, Тре, Лиз, Мет) и заменимые. Две аминокислоты являются условно незаменимыми (Арг, Гис), т.е. их синтез происходит в недостаточном количестве.
По полярности молекулы
К неполярным относят аминокислоты, имеющие алифатические углеводородные цепи (аланин, валин, лейцин, изолейцин, метионин, пролин) и ароматические кольца (фенилаланин, триптофан, тирозин).
К полярным незаряженным относятся аминокислоты, имеющие гидроксильные группы (серин, треонин, тирозин), амидные группы (аспарагин, глутамин), тиольную группу (цистеин) и глицин.
Аспарагиновая и глутаминовая аминокислоты имеют в радикале дополнительную карбоксильную группу, отрицательно заряжены и, соответственно, полярны. К аминокислотам с полярными положительно заряженными радикалами относятся лизин, аргинин, гистидин.