Биохимия
Ингибирование ферментов
В медицине активно разрабатываются и используются соединения, изменяющие активность ферментов с целью регуляции скорости метаболических реакций и уменьшения синтеза определенных веществ в организме.
Подавление активности ферментов обычно называют ингибированием, однако это не всегда корректно. Ингибитор – это вещество, вызывающее специфичное снижение активности фермента. Таким образом, неорганические кислоты и тяжелые металлы ингибиторами не являются, но являются инактиваторами, т.к. снижают активность многих ферментов, т.е. действуют неспецифично.
- По прочности связывания фермента с ингибитором ингибирование бывает обратимым и необратимым.
- По отношению ингибитора к активному центру фермента ингибирование делят на конкурентное и неконкурентное.
Необратимое ингибирование
При необратимом ингибировании происходит связывание или разрушение функциональных групп фермента, необходимых для проявления его активности.
Например, вещество диизопропилфторфосфат прочно и необратимо связывается с гидроксигруппой серина в активном центре ацетилхолинэстеразы, гидролизующей ацетилхолин в нервных синапсах. Ингибирование этого фермента предотвращает распад ацетилхолина в синаптической щели, в результате чего отсутствует дальнейшая передача сигнала по нерву.

Еще один пример связан с ингибированием ацетилсалициловой кислотой (аспирином) ключевого фермента синтеза простагландинов – циклооксигеназы. Эта кислота входит в состав противовоспалительных средств и используется при воспалительных заболеваниях и лихорадочных состояниях. Присоединение ацетильной группы к гидроксильной группе серина в активном центре фермента вызывает инактивацию последнего и прекращение синтеза простагландинов.
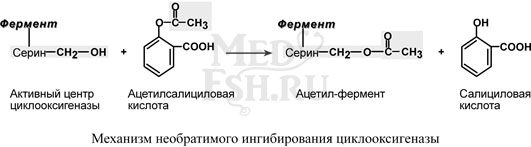
Конкурентное ингибирование
При таком виде ингибирования ингибитор по своей структуре похож на субстрат фермента. Поэтому он соперничает с субстратом за активный центр (за контактный участок), что приводит к уменьшению связывания субстрата с ферментом и нарушению катализа. В этом состоит особенность конкурентного ингибирования – возможность усилить или ослабить ингибирование через изменение концентрации субстрата. При данном ингибировании максимальная скорость реакции остается вполне достижимой при создании высоких концентраций субстрата.
Например:
- К конкурентным ингибиторам относят антиметаболиты или псевдосубстраты,
например, антибактериальные средства сульфаниламиды, схожие по структуре с p-аминобензойной кислотой, компонентом фолиевой кислоты. При лечении сульфаниламидами в бактериальной клетке конкурентно нарушается использование p-аминобензойной кислоты для синтеза дигидрофолиевой кислоты, что и вызывает лечебный эффект. - Ингибирование сукцинатдегидрогеназы малоновой кислотой, структура которой схожа со структурой субстрата этого фермента – янтарной кислоты (сукцината).
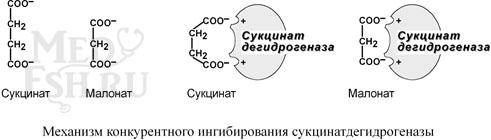
- В качестве других примеров лекарственных конкурентных ингибиторов можно привести:
- ингибитор синтеза холестерина ловастатин, ингибирующий ГМГ-SКоА-редуктазу,
- противоопухолевый препарат метотрексат, подавляющий дигидрофолатредуктазу,
- непрямой антикоагулянт дикумарол, конкурент витамина К,
- антигипертензиный препарат метил-ДОФА, подавляющий активность ДОФА-декарбоксилазы,
- средство лечения подагры аллопуринол, ингибирующий ксантиноксидазу.
Известным примером является конкуренция этанола и метанола за алкогольдегидрогеназу. Эта конкуренция не является ингибированием в буквальном смысле слова, т.к. фермент остается активным, но эти два спирта эффективно вытесняют друг друга из активного центра фермента, что используется в клинике при отравлении метанолом.
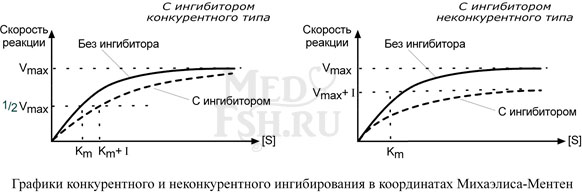
Используя терминологию кинетики Михаэлиса-Ментен можно сказать, что конкурентный ингибитор уменьшает сродство фермента к субстрату, повышая константу Михаэлиса (Km), максимальная скорость реакции (Vmax) остается при этом неизменнной.
Неконкурентное ингибирование
Данный вид ингибирования связан с присоединением ингибитора не в активном центре, а в другом месте молекулы. Это может быть аллостерическое ингибирование, когда активность фермента снижается естественными модуляторами (см выше), или связывание с ферментом каких-либо токсинов. Например, синильная кислота (цианиды) связывается с гемовым железом ферментов дыхательной цепи и блокирует клеточное дыхание.
Особенностью неконкурентного ингибитора является его способность связываться с ферментом независимо от субстрата, т.е. изменение концентрации субстрата никак не влияет на образование комплекса фермент-ингибитор.
Максимальная скорость реакции (Vmax) при этом снижается, константа Михаэлиса (Km) не изменяется, т.е. добавление дополнительного субстрата не может повлиять на состояние активного центра и работу фермента.
Бесконкурентное ингибирование
В этом случае ингибитор связывается не в контактном участке фермента (как при конкурентном ингибировании), а только с фермент-субстратным комплексом. Поэтому повышение концентрации субстрата, увеличивая количество фермент-субстратного комплекса, усиливает и связывание ингибитора с ним. Максимальная скорость реакции уменьшается.
Смешанное ингибирование
При таком ингибировании ингибитор способен присоединяться и к активному центру, и в других частях молекулы. Максимальная скорость реакции уменьшается.