Биохимия
Физико-химические свойства белков
К свойствам белков относят амфотерность, растворимость, способность к денатурации, коллоидные свойства.
Амфотерность
Так как белки содержат кислые и основные аминокислоты, то в их составе всегда имеются свободные кислые (СОО–) и основные (NH3+) группы.
Заряд белка зависит от соотношения количества кислых и основных аминокислот. Поэтому, аналогично аминокислотам, белки заряжаются положительно при уменьшении рН, и отрицательно при его увеличении. Если рН раствора соответствует изоэлектрической точке белка, то заряд белка равен 0.
Если в пептиде или белке преобладают кислые аминокислоты (глутамат и аспартат), то при нейтральных рН заряд белка отрицательный и изоэлектрическая точка находится в кислой среде. Для большинства природных белков изоэлектрическая точка находится в диапазоне рН 4,8-5,4, что свидетельствует о преобладании в их составе глутаминовой и аспарагиновой аминокислот.
Если в белке преобладают основные аминокислоты (лизин и аргинин) – при нейтральных рН заряд обусловлен этими, положительно заряженными, аминокислотами.
Амфотерность имеет значение для выполнения белками некоторых функций, например, их буферные свойства, т.е. способность поддерживать неизменным рН крови, основаны на способности присоединять ионы Н+ при закислении среды или отдавать их при защелачивании.
С практической стороны наличие амфотерности позволяет разделять белки по заряду (электрофорез) или использовать изменение величины рН раствора для осаждения какого-либо известного белка. Наличие как положительных, так и отрицательных зарядов в белке обусловливает их способность к высаливанию (см «Обратимое осаждение» белков), что удобно для выделения белков в нативной конформации.
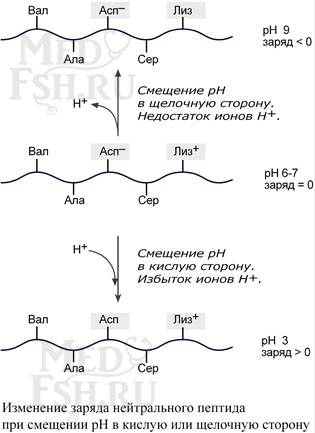
Влияние рН на заряд белка
При смещении рН в растворе изменяется концентрация ионов Н+. При закислении среды (при снижении рН) ниже изоэлектрической точки ионы Н+ при соединяются к отрицательно заряженным группам глутаминовой и аспарагиновой кислот и нейтрализуют их. Заряд белка становится положительным.
При увеличении рН в растворе выше изоэлектрической точки концентрация ионов Н+ снижается и положительно заряженные группы белка (NH3+-группы лизина и аргинина) теряют протоны, их заряд исчезает. Суммарный заряд белка становится отрицательным.
При физиологических рН буферная емкость белков плазмы крови весьма ограничена, т.к. диапазон смещения рН крови даже при патологии не захватывает изоэлектрические значения рН для глутамата, аспартата, лизина, аргинина. Только гемоглобин, который содержит до 8% гистидина (pI 7,6) обладает существенной буферной емкостью.
Растворимость
Так как большинство белков несет много заряженных групп, то в целом они водорастворимы. Растворимость объясняется:
- наличием заряда и взаимоотталкиванием заряженных молекул белка,
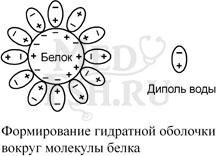
- наличием гидратной оболочки – чем больше полярных и/или заряженных аминокислот в белке, тем больше гидратная оболочка (например, 100 г белка альбумина связывает 30-50 г воды).
Методы осаждения белков
Так как растворимость белков зависит от заряда и наличия гидратной оболочки, то исчезновение одного или обоих этих факторов ведет к осаждению белка.
Денатурация
Денатурация – необратимое осаждение белка из-за разрыва связей, стабилизирующих четвертичную, третичную, вторичную структуры белка, сопровождаемое изменением растворимости, вязкости, химической активности, снижением или полной потерей биологической функции.
- Физическая денатурация – повышение температуры, ультрафиолетовое и микроволновое излучение, механические воздействия, ионизация заряженными частицами.
- Химическая:
- кислоты и щелочи образуют водородные связи с пептидными группами,
- органические растворители образуют водородные связи и вызывают дегидратацию,
- алкалоиды образуют связи с полярными группами и разрывают систему водородных и ионных связей
- тяжелые металлы взаимодействуют с заряженными радикалами, нейтрализуют отрицательные заряды и разрывают систему водородных и ионных связей.
Обратимое осаждение
Обратимость осаждения белков обусловлена сохранением первичной структуры белка. Восстановление физико-химических и биологических свойств белка называется ренативация (ренатурация). Иногда для ренативации достаточно просто удалить денатурирующий объект.
Высаливание
Высаливание – это добавление растворов нейтральных солей (Na2SO4, (NH4)2SO4). Анионы (SO42–) и катионы (Na+, NH4+) взаимодействуют с зарядами белка (группы NH4+ и COO–). В результате заряд исчезает, и соответственно, исчезает взаимоотталкивание молекул. Одновременно резко уменьшается гидратная оболочка. Это ведет к «слипанию» молекул и осаждению.
Так как белки плазмы крови отличаются по размерам, заряду, строению, то можно подобрать такие количества соли, которые вызовут осаждение менее устойчивых белков, пока другие еще будут растворены.
Например, подобным образом раньше определяли соотношение альбумины/глобулины в плазме крови. Альбумины, как более полярные молекулы, остаются в растворенном состоянии при 50% насыщении раствора нейтральными солями, в то время как глобулины в этих условиях уже осаждаются. В норме соотношение альбумины/глобулины в плазме крови равно 1,2-1,8.
Осаждение водоотнимающими средствами
При добавлении водоотнимающих средств (ацетон, этанол) происходит отнятие у белка гидратной оболочки, но не заряда. Растворимость несколько снижается, но денатурации не наступает. Например, антисептическое действие этанола.
Изменение рН
Мягкое изменение рН до изоэлектрической точки белка ведет к исчезновению заряда, уменьшению гидратной оболочки и снижению растворимости молекулы.
Свойства белковых растворов
Свойства белковых растворов определяются большими размерами молекул, т.е. белки являются коллоидными частицами и образуют коллоидные растворы. К свойствам коллоидных растворов относятся:
- Рассеивание луча света, проходящего через белковый раствор, и образование светящегося конуса – эффект Тиндаля.
- Малая скорость диффузии.
- Неспособность белковых частиц проникать через полунепроницаемые мембраны (целлофан), т.к. их поры меньше диаметра белков. Это используется в диализе – очистка белковых препаратов от посторонних примесей и лежит в основе работы «искусственной почки» для лечения острой почечной недостаточности.
- Создание онкотического давления, то есть перемещение воды в сторону более высокой концентрации белка, что проявляется, например, как формирование отеков при повышении проницаемости сосудистой стенки.
- Высокая вязкость в результате сил сцепления между крупными молекулами, что проявляется, например, при образовании гелей и студней.